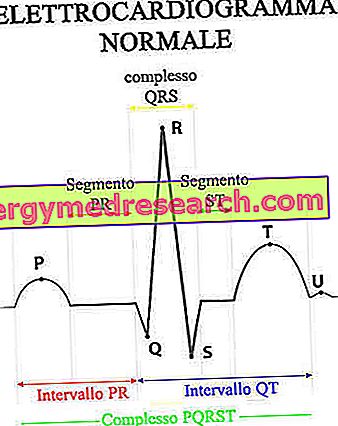
Протеини
Протеини су полимерни молекули састављени од више од 100 аминокиселина везаних пептидним везама (краћи аминокиселински ланци се називају полипептиди или пептиди); структура протеина може бити више или мање дуга, пресавијена на себи и фиксирана на друге молекуле (фактори који одређују његову комплексност и карактеришу његову биолошку функцију). Ове структуре се могу сврстати у: примарну структуру, секундарну структуру (α-хеликс и β-летак), терцијарну структуру и квартерну структуру.

Протеин фунцтионс
У природи, протеини обављају многе функције и најпознатији је несумњиво структурни; само мислите да је свака матрица ткива нашег организма заснована на скелетном или полимерном мозаику формираном од пептида (нпр. мишићна влакна, коштани матрикс, везивно ткиво и, са одређеног становишта, чак и крв).
Не мање важна је и функција био-регулације и хемијске / хормоналне медијације, заправо протеини су основни састојци ензима и многих хормона.
У крви, протеини такође играју веома важну транспортну функцију; то је случај хемоглобина (пренос кисеоника), трансферина (транспорт гвожђа), албумина (транспорт липидних молекула), итд.
Још у циркулаторном току, протеини су корисни као имунолошка одбрана; они чине АНТИЦОРПИ, есенцијалне молекуле које производе лимфоцити корисне у одговору организма на патогене.
Коначно, протеини - али тачније аминокиселине - могу се користити у енергетске сврхе помоћу неоглукогенезе у јетри и пружају 4 килокалорије (кцал) по граму. То је прилично компликован процес који, преко трансаминације и деаминације, омогућава телу да производи глукозу у хипогликемијским условима (евентуално изазваним постом, посебно интензивним и / или продуженим мишићним напором, патолошким стањима или неповољним клиничким условима, итд.). Неке неоглукогене аминокиселине такође могу бити кетогене, тако да њихова конверзија одређује ослобађање молекула киселине званих кетонска тела.
Напомена. Енергетска функција протеина треба да буде маргинална и подређена оној шећера и масти.
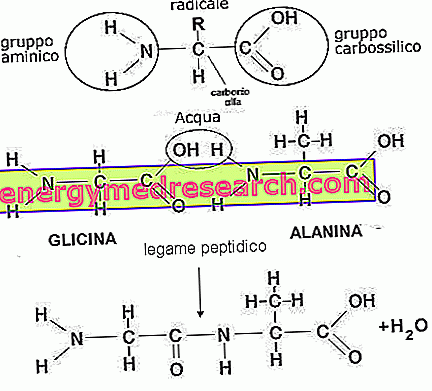
Аминокиселине
Аминокиселине су квартарни молекули састављени од угљеника, водоника, кисеоника и азота. Познато је више од 500 типова и њихова комбинација разликује небројене облике пептида. Обичне, Л-аминокиселине, су 20: аланин, аргинин, аспарагин, аспарагинска киселина, цистеин, глутаминска киселина, глутамин, глицин, хистидин, изолеуцин, леуцин, лизин, метионин, фенилаланин, пролин, серин, треонин, трифофан, тирол и валин . Из метаболизма потоњих могуће је добити широк спектар не-уобичајених или повремених аминокиселина које углавном чине хормоне, ензиме или посредне молекуле (карнитин, хомоцистеин, креатин, таурин, итд.).
Међу обичним аминокиселинама, неке НЕ могу бити синтетизоване од стране организма и називају се ОСНОВНИМ; за одраслог мушкарца има 9: фенилаланин, леуцин, изолеуцин, лизин, метионин, треонин, триптофан и валин . Код деце има их укупно 11; на претходне се додају: хистидин и аргинин .
Друге класификације аминокиселина су: на основу поларитета њихових бочних ланаца (неутрални аполарни, поларни неутрални, киселински набоји, основне набоје) или засновани на типу радикалне групе (хидрофобна, хидрофилна, кисела, базична, ароматична).
Аминокиселине са разгранатим ланцем
Међу есенцијалним постоје и три аминокиселине са разгранатим ланцем (БЦАА), редом: леуцин, изолеуцин и валин ; Посебност која разликује аминокиселине разгранатог ланца од других представљена је различитим метаболичким путем производње енергије.
Као што је већ објашњено, након трансаминације-деаминације, већина аминокиселина може бити намењена неоглукогенези и ући у Кребсов циклус у облику оксалацетата или пирувата . На крају, ако постоји било каква стварна потреба, неке од аминокиселина присутних у циркулационом току улазе у хепатоците јетре и излазе као глукоза; ово није случај за амино киселине са разгранатим ланцем. У поређењу са осталима, БЦАА су директно употребљиви молекули из мишића, и та посебност их чини много ефикаснијим у директној производњи енергије иу конверзији за реконституцију резерви гликогена; подразумева се да, ако је организам довољно храњен, катаболизам разгранатих аминокиселина представља готово нерелевантни неоглукогенетски део; Глукоза остаје УВЕК примарни извор енергије, дакле, у условима гликемије и СУКЛАДНИХ резерви гликогена, чак и за време обичних спортских перформанси нема разлога да се плаши да мишић треба вишак разгранатих аминокиселина.