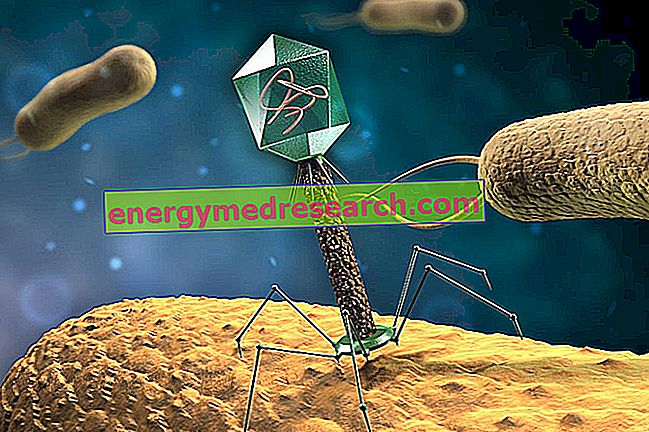
Бактерије такође имају своје природне непријатеље и врло често капитулирају нападима непријатеља много мањим од њих, тако микроскопским и једноставним да се чак не могу сматрати живим организмима. Говоримо о неким вирусима, који се називају бактериофагима, који користе бактеријске ћелије да се реплицирају. Вирус, у ствари, за разлику од бактерија, не може се сматрати живим организмом, јер се не може реплицирати; у том смислу се каже да су вируси обавезујући паразити, управо зато што морају да искористе друге ћелије да се репродукују.
Када је експлоатисана ћелија људска, вируси стварају одређену штету организму; међутим, када се патогена бактеријска ћелија искористи за људе, бактериофаги могу постати савезници нашег здравља; и то би могло постати још више у будућности, с обзиром на растући проблем резистенције на лијекове и посљедичне бактеријске неосјетљивости на антибиотике.
Ове "природне дроге" су такође посебно јефтине, јер су фаги највећи биолошки ентитет на Земљи. Они су такође веома специфични, с обзиром да сваки бактериофаг делује на одређени начин на бактеријске врсте или чак према специфичним сојевима; према томе, мешавина фага која се користи за лечење болести мора бити веома специфична за појединог пацијента, нека врста пажљиво калибрисаног коктела након што се разуме које бактерије узрокују инфекцију. Овај хипер-селективни приступ компликује терапијску употребу бактериофага с једне стране, али, с друге стране, избјегава убијање добрих бактерија, што је уобичајена нуспојава традиционалних терапија широког спектра антибиотика. Стога, деловање фага не уништава комензалну микрофлору црева и на тај начин избегава појаву нежељених ефеката као што су дијареја и опортунистичке секундарне инфекције.
Терапијска употреба бактериофага развијена је током прве половине прошлог века у бившем Совјетском Савезу, посебно у Грузији захваљујући истраживању Георгеа Елиаве. На Западу, научни интерес за терапију фагима био је ублажен појавом антибиотика, али је недавно повратио снагу управо због обновљеног интереса за алтернативне терапије. ФДА, на пример, одобрила је додавање специфичних фага за салмонелу и Есцхерицхиа Цоли у различитим прехрамбеним производима. У узгоју рибе, фаги се већ данас користе као валидна алтернатива употреби антибиотика.
Поред бактериофага у тото, може се користити и оружје којим ови вируси добијају бактеријску одбрану, на пример лизини који могу да пробију зид бактерија. Штавише, технике генетског инжењеринга већ су створиле "супер фаге", способне да нападају и лизирају више бактеријских врста.
Што се тиче опасности по здравље, ако је терапија добро избалансирана, то скоро да и не постоји. Људски организам је, наиме, посебно навикнут на бављење фагима, који се налазе свуда, у свему што додирнемо, једемо или пијемо. Штавише, експанзија фага у људском организму зависи од обима инфективне бактеријске популације: пошто се последње смањује због дејства самих фага, вируси такође смањују своју концентрацију. Ово, између осталог, значи да када се доза фага убризга у тело, ови вируси се брзо развијају и повећавају своју бактерицидну ефикасност током времена (за разлику од антибиотика за које су потребне додатне дозе). Не само то, чињеница да фаги убијају бактеријске ћелије које стварају ћелијске фрагменте чини њихово дјеловање доводећи људски имуни систем до активације са већим интензитетом; само замислите, на пример, фрагменте ЛПС (липополисахарида) који долазе из деградираног бактеријског зида.
Потенцијалне опасности по здравље укључују могуће присуство бактеријских токсина у припреми фага и пренос бактеријских гена између вирулентних сојева. Данас, у ствари, знамо да су фаги одговорни за већину болести повезаних са токсинима; то је зато што се фаги реплицирају у бактеријској ћелији да производе и / или ослобађају токсине који изазивају типичне симптоме многих болести; то је случај, на пример, са пертусисом, гримизном грозницом и колером. Осим тога, лиза неких бактеријских врста може довести до ослобађања великих количина ендотоксина који, изван одређених граница, прелазе са стимулације имунолошког система на хиперактивацију, до појаве токсичног шока због огромног повећања производње цитокина. инфламматори. Ова препрека се може превазићи техникама генетског инжењеринга, са циљем да се лишавају бактериофага гена неопходних за синтезу лизина; ово такође ограничава репликацију фага, јер без лизина вируси реплицирани унутар бактеријске ћелије не могу да побегну. Други проблем, с друге стране, решен је избегавањем коришћења фаза лизогеног циклуса, јер би они, као што је поменуто, могли да фаворизују проблем отпорности на антибиотике уместо да га реше.



