општост
"Дајте ми грозницу и ја ћу излечити сваку болест": ова изјава, приписана грчком лекару Хипократу (400 пне), показује како је човек одавно осетио терапеутски потенцијал топлоте.
Први документарни докази о могућем љековитом учинку високих температура у лијечењу тумора датирају из 1866. године, када је њемачки лијечник Бусцх уочио потпуну ремисију саркома на лицу пацијента након поновљених напада високе температуре.

Данас, због потенцијалних терапеутских предности ове технике, хипертермија је препозната као четврта колона онкологије.
Шта је онколошка хипертермија?
Онколошка хипертермија је клинички третман за лечење малигних тумора, који се може користити самостално или чешће у комбинацији са радиотерапијом и хемотерапијом. Тренутно, у ствари, ова техника се не користи као алтернатива, већ као додатак другим третманима против рака; ово повезивање омогућава узајамно побољшање терапијске ефикасности. Осим тога, повезаност са хипертермијом смањује дозе хемотерапије и зрачења, уз значајно смањење нежељених ефеката повезаних са стандардним терапијама.
Врсте хипертермије
Терапијски ефекат хипертермије за лечење тумора може се искористити коришћењем различитих приступа и технологија.
Облици тумора који су показали добар одговор на хипертермију:
- Меланом и други облици рака коже
- Рак дојке
- Сарком меког ткива
- Рак мокраћне бешике
- Карциноми главе и врата
- Рак грлића материце и јајника
- Рак простате
- Ректални рак
- Карциноми аксиларних или торакалних зидова
Температура и трајање излагања топлоти су две основне количине које треба калибрирати да би се добио жељени терапеутски резултат. Међутим, поред опсега достигнуте температуре и времена примене топлоте, веома је важно да се процени извор који генерише грејање и његово место примене. На пример, микро таласи, радиофреквенције, наночестице, ултразвук, ласери итд. Могу се користити споља или изнутра у телу.
Све ове варијабле бира онколог на основу карактеристика различитих клиничких случајева.
Резултати
У онкологији шансе за опоравак од малигног тумора зависе од многих фактора, као што су тип и стадијум тумора, његова величина и локација, старост и општа здравствена стања пацијента.
Имајући све ово у виду, неколико студија је показало да хипертермија представља одличан адјувант класичним техникама излечења тумора, који показују неколико контраиндикација за пацијенте.
За неке типове тумора, повезујући радиотерапију (и / или хемотерапију) са хипертермијом, постигнуто је повећање од 30-100% у потпуној ремисији и / или стопама преживљавања 2 и 5 година, у поређењу са само за радиотерапију (и / или хемотерапију). За неке врсте рака, као што је рак ректума, резултати лијечења показали су се још охрабрујућим (до + 500% стопе преживљавања на пет година).
Класична хипертермија 41-45 ° Ц
Класична онколошка хипертермија има за циљ да загреје туморске ћелије без оштећења околних здравих ткива.
- Ако су достигнуте температуре између 41-43 ° Ц ( блага хипертермија ), главни циљ је повећати осјетљивост неоплазме на радиотерапију и / или третмане кемотерапијом.
- Ако су достигнуте температуре између 43 и 46 ° Ц, директан утицај топлоте на убијање ћелија рака постаје све важнији.
У зависности од случаја, класични третман хипертермије траје у просеку од 40 до 60 минута и понавља се два до три пута недељно . Чешћи третмани имају тенденцију да индукују терморезистентност (или термотолеранцију, ако вам је драже ) у ћелијама рака, што их чини способни да издрже високе температуре.
У зависности од случаја, извор топлоте може имати различите димензије и бити постављен на различитим дубинама, у различитим органима или анатомским деловима људског тела. На пример, међу модерним техникама хипертермије постоји и могућност директне имплантације микроталасних антена у субкуту.
Како ради
НЕПОСРЕДНО ОШТЕЋЕЊЕ ЦИЉА ТУМОРА
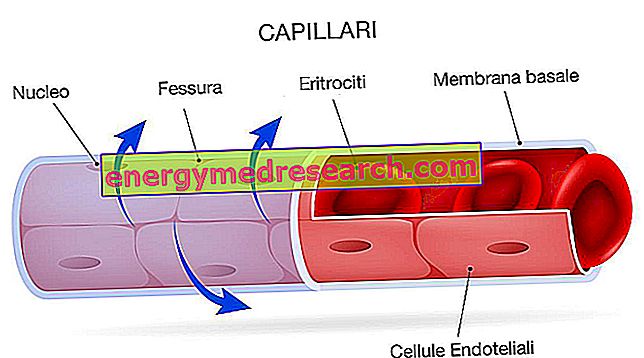
Ефикасност онколошке хипертермије заснива се на хаотичној ангиогенези туморских ткива. У суштини, микроокружење тумора готово увек представља хаотичну и неорганизовану васкуларну скелу; као резултат тога, велике површине тумора (посебно централна маса) примају недовољне количине крви и кисеоника. Због ових промена у крвним судовима, неопластична маса није у стању да расипа топлоту као нормална ткива ; другим речима, тумори имају тенденцију да трпе много више топлоте од здравих ткива, јер неке од њихових области примају мало крви (која делује као права расхладна течност); из истог разлога, ове области већ пате од недостатка кисеоника и хранљивих материја и обиља отпадних производа (хипер ацидификација).
Топлота коју даје хипертермија узрокује оштећење плазма мембране, ћелијског скелета и језгра; ако је величина и трајање хипертермије довољна, ово оштећење директно доводи до смрти ћелије рака. Директне штете постају значајне на температурама> 43 ° Ц: индиректно, које ћемо ускоро видети, је типично за такозвану "благу хипертермију" (42-43 ° Ц).
ИНДИРЕКТНА ШТЕТА: АДИУВАНТ ХИПЕРТХЕРМИА
Наше тело реагује на пораст локалне температуре повећањем протока крви у погођеном подручју. На тај начин веће количине циркулишуће крви "апсорбују" топлоту, чувајући ткива од термичког оштећења. Овај одговор се јавља и на нивоу тумора, тако да - у границама специфичне васкуларне дезорганизације - туморске ћелије изложене благом порасту температуре добијају веће количине крви и кисеоника :
- у крви могу бити присутни антитуморни лекови, који захваљујући вазодилатацији индукованој хипертермијом могу лакше доћи до мање васкуларизованих неопластичних подручја; деловање ових лекова такође може бити олакшано ћелијским променама (повећана пермеабилност плазма мембране) и ензимским (денатурација протеина) индукованим топлотом.
Када температуре у маси тумора пређу 43 ° Ц, уместо тога долази до смањења протока крви у туморима, са последичним „заробљавањем“ молекула лека.
Предности повезаности хипертермије и хемотерапије потврђене су у неколико студија. Антиканцерогени лекови као што су Мелфалан, Блеомицин, Адриамицин, Митомицин Ц, Нитросурее, Цисплатин су најефикаснији када се дају током хипертермије. У том смислу, међутим, треба нагласити да нису сви познати хемотерапијски лекови увећали своју ефикасност ако се користе у хипертермичком окружењу.
- Повећана количина кисеоника у ткиву тумора појачава ефекте радиотерапије, која се заснива пре свега на оштећењу ДНК изазваној реактивним врстама кисеоника (слободни радикали) генерисаним зрачењем. Као што се види за хемотерапију, активност радиотерапије је такође олакшана неопластичним ћелијским оштећењем повезаним са оштећењем које је претходно изазвала хипертермија.
Заједничко завршавање и појачавање дјеловања између хипертермије и радиотерапије произлази из чињенице да:
- оштећење изазвано хипертермијом је веће у областима ниске васкуларизације (које не могу ефикасно распршити топлоту), као што је хипоксигенирано централно језгро неопластичног нодула;
- оштећење изазвано радиотерапијом је уместо тога веће у областима високе васкуларизације (богатије кисеоником), као што су периферне области тумора тумора;
- ова два третмана врше своју максималну ефикасност оштећујући тумор у различитим фазама ћелијског циклуса, што резултира комплементарним иу том смислу.
Чини се да је максимални терапијски добитак постигнут практицирањем хипертермичког третмана у року од једног или два сата након радиотерапије. Што се тиче термо-хемотерапије, ова два третмана могу се вршити истовремено.
Онколошка хипертермија може допринети редукцији туморске масе у погледу операције хируршког уклањања. Постоје и предности у смислу аналгетског ефекта (смањење бола изазваног компресијом ткива због неопластичне масе).
Остали облици хипертермије
ХИПЕРТЕРМИЈА ТОТАЛНОГ ТЕЛА
Као што име сугерише, овај облик хипертермије укључује гријање цијелог тијела. Циљ, у овом случају, није да се директно уништи туморска маса, већ да се одреди њена индиректна ремисија путем побољшања имуног система . Ово последње, у ствари, има унутрашњу способност да уништи ћелије рака, и овај капацитет се огромно повећава у условима високе телесне температуре.
Сврха тоталне телесне хипертермије је да изазове вештачку грозницу, симулирајући напад грознице око 39-41 ° Ц. У том смислу, могу се користити термалне или водено покривене коморе.
Употреба целокупног тела је углавном ограничена на експериментално окружење за лечење раширених метастаза . Техника захтева пажљиво праћење пацијента како би се избегло оштећење од хипертермије, што такође може бити веома озбиљно. То је такође адјувантна терапија, која се користи у сарадњи са другим терапијама против рака.
ИНТЕРСТИТИАЛ ХИПЕРТХЕРМИА
Као што се види за брахитерапију - у коју се у циљно ткиво уграђују мали радиоактивни извори - интерстицијална хипертермија укључује имплантацију уређаја који могу генерирати локалну хипертермију. У том смислу, користе се антене које греју захваљујући снабдевању микроталасима.
ХИПЕРТЕРМИЈА ИНФУЗИЈЕ И ХИПЕРТЕРМИЈА У ПЕРФУЗИЈИ
Интраперитонеална инфузијска хипертермија заснива се на употреби перитонеалних испирања са медицинским раствором на високим температурама. Користи се у случајевима тешких перитонеалних неоплазми, као што су перитонеални мезотелиом и рак желуца. На истом принципу, друге технике хипертермије се заснивају на инфузији терапеутских раствора загреваних у другим шупљинама, као што су плеурална или бешика.
Приликом перфузионе хипертермије дошло је до екстракорпоралне циркулације, са загревањем дела крви и поновним увођењем истог са додатком хемотерапијских лекова, како би се добиле високе концентрације лека у перфузионом ткиву.
АБЛАТИВЕ ХИПЕРТХЕРМИА
У овом случају температуре су много веће (50-100 ° Ц), али се примјењују само неколико минута. Сличне температуре могу произвести тренутну и тоталну некрозу третираних ткива. Топлота се генерише применом наизменичне струје кроз електроде или употребом ласера или електромагнетних зрачења, примењених директно на масу тумора (инвазивни третман). Највећа потешкоћа лежи у очувању здравог ткива које окружује тумор.
Иако ова техника искоришћава терапеутски ефекат топлоте, због механизма дјеловања она је изван онога што је традиционални концепт хипертермије.
НОВИ РАЗВОЈ У ХИПЕРТЕРМИЈИ
Наука о хипертермији се константно развија, да би се развили све селективнији третмани како би се уништиле ћелије рака без оштећења здравих.
Најновији развој се односи на неинвазивну термометрију уз употребу магнетних резонантних скенера (за процену температуре у различитим подручјима тумора), магнетно-флуидну хипертермију и употребу термосензитивних липосома. Ово последње су лекови затворени у липидним везикулама, стабилни при нормалним температурама тела, али способни да ослободе свој садржај на температурама од око 40-43 ° Ц; ови лекови стога представљају идеалну комбинацију са регионалним хипертермијским третманима.
ограничења
Разумијевање механизама дјеловања хипертермије и посљедичне потенцијалне користи у лијечењу тумора може довести до претераног читалачког ентузијазма за ову врсту лијечења.
Иако је подржан дискретним доказима о ефикасности, примена хипертермије у онколошком пољу чува неке критичне тачке. Прије свега у клиничкој пракси могу постојати контраиндикације или ограничења која интервенцију чине непрактичном; неке технике, на пример, укључују више или мање инвазивне хируршке процедуре; други су и даље углавном ограничени на експерименталну поставку. Такође је неопходно превазићи техничка ограничења везана за емисију топлоте, дубину продирања, хомогеност термалних поља и потребу за исправним термичким дозирањем како би се избјегло оштећење здравих ткива. У том смислу, даљње студије и технолошки развој су пожељни како би се развили ефикасни и стандардизовани протоколи који ће се усвојити у различитим клиничким ситуацијама.